中新网12月27日电 据国家卫健委网站消息,为落实国务院办公厅《关于改革完善仿制药供应保障及使用政策的意见》和国家卫生健康委等6部门《关于印发深化医药卫生体制改革2023年下半年重点工作任务的通知》有关制定鼓励仿制药品目录的部署和要求,国家卫生健康委联合工业和信息化部、国家知识产权局、国家医保局、国家疾控局、国家药监局等部门组织专家对国内专利即将到期及临床供应短缺(竞争不充分)的药品进行遴选论证,制定了《第三批鼓励仿制药品目录》。
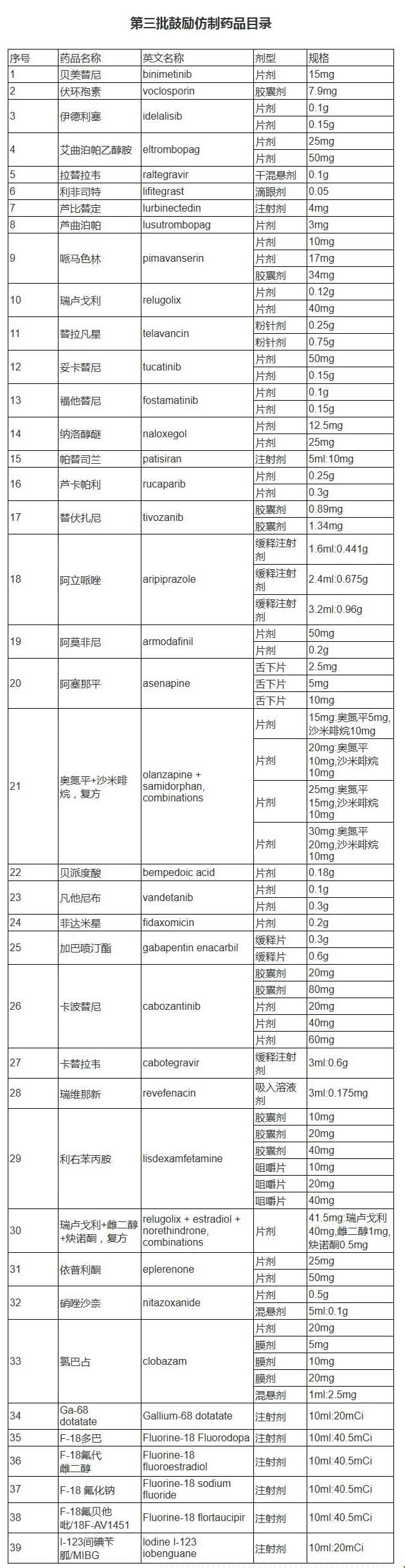
据悉,第三批目录收录39个品种,涉及75个品规、13种剂型,覆盖抗肿瘤药及免疫调节剂、抗感染用药、神经系统用药、放射性诊断剂、心血管系统用药等12个方面治疗用药。
第三批目录以临床用药需求为导向,丰富临床用药选择,提升临床用药质量。一是填补国内临床用药空白。第三批目录收录的多个药品为境外已上市,境内未上市品种,是该治疗领域的全球首个药物,具有全新的作用机制。如治疗成人遗传性转甲状腺素介导的淀粉样变性的多发性神经病的小干扰RNA药品帕替司兰,联合免疫抑制剂治疗成人活动性狼疮肾炎的口服药品伏环孢素等。二是提高药品可及性。第三批目录收录的部分药品,虽然同作用机制药品已经在境内上市,但由于临床需求量大,存在供应短缺的风险,因此也纳入鼓励仿制的范围,满足临床用药可及。三是鼓励创新制剂技术。第三批目录收录的药品剂型除了有传统的片剂、胶囊剂外,还收录了缓释注射剂、干混悬剂、舌下片等新型药物制剂,以及儿童适宜的剂型和新的复方制剂,更好满足不同患者的用药需求,提高患者适宜性。四是提高临床诊断准确性。第三批目录收录了6个放射性药品,可用于影像学的诊断和定位,均为境内未上市药品,对于及时确诊疾病及病程意义重大。
第三批目录主要有三个特点:一是覆盖疾病领域范围广。第三批目录所收录药品是我委组织多部门、多学科专家遴选论证产生,采取药品信息梳理、专业科别咨询、剂型规格逐一讨论和专家独立投票等多种形式,充分听取临床、药学、公共卫生、药品审评、知识产权等方面专家意见,收录药品包括抗肿瘤、传染病治疗及放射性诊断等药物,收录混悬剂等儿童适宜剂型。二是重视与参比制剂备案信息的协同。第三批目录药品在剂型规格遴选上审慎参考国家药品监督管理部门发布的仿制药参比制剂目录,收录药品多为已有参比制剂的品种,提升企业仿制效率。三是兼顾企业研发积极性。第三批目录遴选过程中,通过数据分析和专家论证等方式综合评估了药品的临床应用前景、生产工艺难度和潜在市场空间,提升企业仿制可行性。
此前,国家卫生健康委联合相关部门已先后发布2批《鼓励仿制药品目录》,对目录内药品的研发上市起到了有效的鼓励与引导作用。目前,目录内33个品种已获批上市,覆盖抗感染用药、抗肿瘤药及免疫调节剂、神经系统用药等15个方面治疗用药,其中包含7个罕见病用药。
《第三批鼓励仿制药品目录》详情如下: